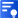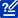藥物開發(fā)人員越來越多地將目光轉(zhuǎn)向大分子,尤其是蛋白質(zhì),將其作為一種治療選擇。配制蛋白質(zhì)治療藥物是一項重大挑戰(zhàn),如果未來的藥物開發(fā)人員不能很好地理解蛋白質(zhì)結(jié)構(gòu)的性質(zhì)和配制蛋白質(zhì)的構(gòu)象特性,那么可能會災(zāi)難性的后果。本指南旨在向生物學(xué)專業(yè)的讀者快速介紹蛋白質(zhì)結(jié)構(gòu)。它還簡要討論了蛋白質(zhì)結(jié)構(gòu)在配制過程中如何發(fā)生變化,以及一些可用于結(jié)構(gòu)測定和蛋白質(zhì)穩(wěn)定性分析的分析方法。
當用于蛋白質(zhì)時,"結(jié)構(gòu) "一詞的含義要比小分子復(fù)雜得多。蛋白質(zhì)是大分子,具有四種不同的結(jié)構(gòu)層次:一級、二級、三級和四級。

一級結(jié)構(gòu)
細胞用于構(gòu)建蛋白質(zhì)的 L-α- 氨基酸有 20 種不同的標準形式。氨基酸含有一個堿性氨基和一個酸性羧基。這種相互的功能性使單個氨基酸能結(jié)合成長鏈,形成肽鍵:一個氨基酸 -NH2 和另一個氨基酸 -COOH 之間的酰胺鍵。少于 50 個氨基酸的序列通常稱為肽,而較長的序列則稱為蛋白質(zhì)和多肽。蛋白質(zhì)可由一個或多個多肽分子組成。肽或蛋白質(zhì)序列帶有游離羧基的末端稱為羧基末端或 C 端。氨基末端和 N 端是指序列中帶有游離 α-氨基的末端。
氨基酸的結(jié)構(gòu)與側(cè)鏈取代基不同。這些側(cè)鏈使最終的肽或蛋白質(zhì)具有不同的化學(xué)、物理和結(jié)構(gòu)特性。蛋白質(zhì)中常見的 20 種氨基酸的結(jié)構(gòu)如圖 1 所示。每個氨基酸都有一個和三個字母的縮寫。這些縮寫通常用于簡化多肽或蛋白質(zhì)的書寫序列。
根據(jù)側(cè)鏈上取代基的不同,氨基酸可分為酸性、堿性和中性。雖然合成人體中的各種蛋白質(zhì)需要 20 種氨基酸,但我們自己只能合成其中的 10 種。其余 10 種被稱為必需氨基酸,必須從飲食中獲取。
蛋白質(zhì)的氨基酸序列由 DNA 編碼。蛋白質(zhì)的合成需要經(jīng)過一系列步驟,即轉(zhuǎn)錄(DNA 鏈被用來創(chuàng)建信使 RNA - mRNA 的互補鏈)和翻譯(mRNA 序列被用作模板,指導(dǎo)組成蛋白質(zhì)的氨基酸鏈的合成)。翻譯后通常會進行糖基化或磷酸化等修飾,這是蛋白質(zhì)發(fā)揮生物功能所必需的。雖然氨基酸序列構(gòu)成了蛋白質(zhì)的一級結(jié)構(gòu),但蛋白質(zhì)的化學(xué)/生物學(xué)特性在很大程度上取決于其三維或三級結(jié)構(gòu)。
二級結(jié)構(gòu)
蛋白質(zhì)或肽鏈或肽鏈具有不同的、各具特色的局部結(jié)構(gòu)構(gòu)象,即二級結(jié)構(gòu),這取決于氫鍵。二級結(jié)構(gòu)的兩種主要類型是α-螺旋和ß-片狀結(jié)構(gòu)。
α-螺旋是一條右手螺旋鏈。α-螺旋中氨基酸基團的側(cè)鏈取代基向外延伸。鏈中每個 C=O 鍵的氧與螺旋下方四個氨基酸中每個 N-H 基團的氫之間形成氫鍵。氫鍵使這種結(jié)構(gòu)特別穩(wěn)定。氨基酸側(cè)鏈的取代基緊靠著 N-H 基團。
ß-片狀結(jié)構(gòu)中的氫鍵發(fā)生在鏈之間(鏈間),而不是鏈內(nèi)(鏈內(nèi))。薄片的形狀由成對的相鄰鏈形成。 一條鏈上的羰基抗原與相鄰鏈上的氨基抗原結(jié)合。兩條鏈可以是平行的,也可以是反平行的,這取決于鏈的方向(從 N 端到 C 端)是相同還是相反。反平行的 ß 鏈因氫鍵更緊密而更穩(wěn)定。
三級結(jié)構(gòu)
蛋白質(zhì)分子的一般三維形狀是三級結(jié)構(gòu)。蛋白質(zhì)分子會彎曲和扭曲,以達到最高穩(wěn)定性或最低能量狀態(tài)。雖然蛋白質(zhì)的三維形狀看似不規(guī)則和隨機,但它是由氨基酸側(cè)鏈組之間的結(jié)合相互作用所產(chǎn)生的大量穩(wěn)定力形成的。
在生理條件下,苯丙氨酸或異亮氨酸等中性、非極性氨基酸的疏水側(cè)鏈往往埋藏在蛋白質(zhì)分子中,保護它們不受水環(huán)境的影響。丙氨酸、纈氨酸、亮氨酸和異亮氨酸的烷基往往會相互形成疏水作用,而芳香基(如苯丙氨酸和酪氨酸的芳香基)往往會相互重疊。氨基酸的酸性或堿性側(cè)鏈通常暴露在蛋白質(zhì)表面,因為它們具有親水性。
通過氧化半胱氨酸的巰基形成二硫橋是穩(wěn)定蛋白質(zhì)三級結(jié)構(gòu)的一個重要方面,因為它能使蛋白質(zhì)鏈的不同部分以共價方式固定在一起。此外,不同側(cè)鏈基團之間也可形成氫鍵。與二硫鍵一樣,這些氫鍵可將蛋白質(zhì)鏈上順序相距甚遠的兩個部分連接起來。鹽橋是氨基酸側(cè)鏈帶正電和帶負電的點之間的離子相互作用,也有助于穩(wěn)定蛋白質(zhì)的三級結(jié)構(gòu)。
四級結(jié)構(gòu)
許多蛋白質(zhì)由多條多肽鏈組成,通常稱為蛋白質(zhì)亞基。這些亞基可以是相同的(如同源二聚體),也可以是不同的(如異源二聚體)。四元結(jié)構(gòu)指的是這些蛋白質(zhì)亞基之間相互作用并組織起來形成更大的聚合蛋白質(zhì)復(fù)合物的方式。蛋白質(zhì)復(fù)合物的最終形狀又通過各種相互作用(如氫鍵、二硫鍵和鹽橋)來穩(wěn)定。圖 2 顯示了蛋白質(zhì)結(jié)構(gòu)的四個層次。
海馬課堂專業(yè)課程輔導(dǎo),輔導(dǎo)不滿意隨心退,試聽課全面升級,3500+嚴選碩博學(xué)霸師資,針對學(xué)生的薄弱科目和學(xué)校教學(xué)進度,匹配背景相符的導(dǎo)師,根據(jù)學(xué)生情況進行1V1專屬備課,課程輔導(dǎo)產(chǎn)品升級贈送考前保障,上課時間靈活安排,中英雙語詳細講解課程中的考點、難點問題,并提供多方位的課后輔導(dǎo),輔助學(xué)生掌握全部課程知識,補足短板。如果你對此還有疑問,或者有更多關(guān)于學(xué)業(yè)輔導(dǎo)方面需求的話,可以添加微信號:hmkt131聯(lián)系海馬課堂的Joye老師哦。